Эпилепсия: основные принципы диагностики и лечения (часть 2)
Содержание:
- Несколько слов об «эпи»-признаках и заключении ЭЭГ.
- 3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
- Online-консультации врачей
- Термины, используемые при расшифровке ЭЭГ
- Классификация ЭЭГ по Cohn
- Аффективно-респираторный синдром: МКБ, классификация
- Симптомы Детской эпилепсии с пароксизмальной активностью на ЭЭГ в затылочной области:
- Образец бланка для интерпретации ЭЭГ
- Патогенез фокальной эпилепсии
- Формы лечения и оказания первой помощи
- Синдром Леннокса-Гасто.
- Причины эпилепсии у детей
- Общие принципы лечения эпилепсии
- Диагностика фокальной эпилепсии
Несколько слов об «эпи»-признаках и заключении ЭЭГ.
Стандартное заключение ЭЭГ многословно, в нем подробно описываются особенности режима функционирования головного мозга. Большая часть описываемых изменений всего лишь нейрофизиологические особенности Вашего организма в данный момент времени и не требуют какой-либо лечебной коррекции, иными словами и с «легкими» и с «умеренными диффузными изменениями» на ЭЭГ люди живут долго и счастливо. Как правило ЭЭГ заключение должна завершать фраза о наличии или отсутствии «очаговых (локальных)» и «пароксизмальных» изменений/нарушений. Строго говоря и то и другое нормой не являются, но и каким-либо «однозначным приговором» никогда не были, наличие в описании ЭЭГ очаговых или пароксизмальных изменений мотивация посетить врача-невролога, который уже на основании ЭЭГ, других исследований и собственного диагностического мышления подскажет какой лечебной тактики надо придерживаться в каждом конкретном случае.
Даже при наличии типичных – как на картинке в учебнике – ЭЭГ изменений патогномоничных для эпилептических нарушений врач функциональной диагностики не имеет право поставить диагноз эпилепсия. Мало того, нередко за эпилептические пароксизмальные изменения принимают то, что к эпи-активности не имеет никакого отношения – например высокочастотную активность в бета-диапазоне (15 и более Гц). Подобный вид активности описывается как явление ирритации (по-русски: раздражение) и свидетельствует о высоком уровне возбуждения в коре. Он может быть признаком, к примеру, депрессивного расстройства, но никак не свидетельствует в пользу эпилепсии.
Ниже приведены «яркие» примеры пароксизмальных изменений эпилептического характера.
Нестойкая паркосизмальная активность — по типу «острые волны-медленные волны», искаженная, спровоцирована фотостимуляцией.
А вот такую активность можно назвать стойкой пароксизмальной и добавить «эпиформного характера», волны настолько высокие что на иллюстрации масштаб уменьшен в два раза.
У того же пациента «цифровая достройка» пространственной локализации очага патологической активности с помощью программы BrainLoc 6.0 (программа пространственной локализации источников патологической активности в структурах головного мозга)
Важно отметить что по сравнению с теми методами диагностики которые оказывают побочное «вредное» воздействие на организм – такие как рентген, МРТ, КТ — снятие биопотенциалов с поверхности тела человека при проведении ЭЭГ, ЭКГ – оказывает на самого человека не больше воздействия чем работающий рядом компьютер
3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
Общая характеристика
Роландическая эпилепсия — одна из форм идиопатической локально обусловленной эпилепсии детского возраста, проявляющаяся преимущественно ночными короткими гемифациальными моторными приступами и имеющая благоприятный прогноз.
Роландическая эпилепсия проявляется в возрасте 2–14 лет. Приступы могут быть парциальными и вторично-генерализованными. Большинство парциальных приступов являются моторными. Типичные приступы, возникающие как в состоянии бодрствования, но все чаще во время сна (преимущественно первая половина ночи), протекают обычно при сохранном сознании и начинаются с соматосенсорной ауры, характеризующейся парестезией щеки, мышц глотки и гортани, ощущением булавочных уколов, онемения в щеке, деснах, языке на стороне, противоположной фокусу. Затем появляются моторные феномены в виде односторонних гемифациальных (с вовлечением лицевой мускулатуры) клонических или тонико-клонических судорог, которые могут распространяться на гомолатеральную руку (фацио-брахиальные приступы) и ногу (унилатеральные приступы).
В начале приступа или в процессе его развития возникают затруднения речи, выражающиеся в полной невозможности говорить или произносить отдельные звуки. Наряду с анартрией отмечается гиперсаливация, характеризющаяся обильной продукцией и выделением изо рта слюны, что способствует возникновению хлюпающих, хрюкающих звуков.
Длительность приступов, как правило, не более 2–3 мин, частота в среднем — 2–6 раз в год .
При роландической эпилепсии в единичных случаях возможно развитие эпилептического статуса .
Для больных с роландической эпилепсии характерен нормальный интеллект и неврологический статус, хотя ряд современных исследователей все же указывают на наличие у таких детей нейропсихологической недостаточности .
Ряд авторов отмечают возможность возникновения при роландической эпилепсии приступов, характеризующихся болями в животе, головокружением, зрительными феноменами (вспышки света, слепота, мелькание предметов перед глазами), которые обычно отмечаются у детей моложе 5 лет; сложных парциальных приступов или типичных абсансов .
К атипичной роландической эпилепсии (синдром псевдоленнокса) относят группу больных в возрасте 2–8 лет, у которых отмечаются простые парциальные гемифациальные и гемиклонические ночные приступы, сочетающиеся с миоклонически-астатическими, атоническими пароксизмами и в ряде случаев с абсансами , но никогда в отличие от истинного синдрома Леннокса-Гасто не бывает тонических судорог . Частота приступов обычно высокая. До дебютирования приступов у детей не отмечается нарушений в нервно-психическом развитии.
Электроэнцефалографические паттерны
Приступная и межприступная ЭЭГ у больных с роландической эпилепсией характеризуется нормальной основной активностью и обычно дифазными спайками, за которыми следует медленная волна. Спайки или острые волны появляются одиночно или группами в средне-височной и центральной области или височно-центрально-теменной области . Они могут наблюдаться как унилатерально (обычно контралатерально гемифациальным приступам), так и билатерально (синхронно или асинхронно). «Роландические» комплексы обычно наиболее отчетливо выражены при открытых глазах (рис. 3.1).
В ряде случаев на ЭЭГ регистрируются генерализованные комплексы «спайк-волна», типичные для абсансов. Острые волны также могут располагаться в затылочной области . Также во время ночного приступа на ЭЭГ может регистрироваться низкоамплитудная быстрая активность в центрально-височной области, переходящая в роландические комплексы с распространением на всю гемисферу и с последующей генерализацией .
При атипичной роландической эпилепсии (синдром псевдоленнокса) фоновая ЭЭГ не изменена либо слегка замедлена и дизорганизована (рис. 3.2а), в ряде случаев, преимущественно в лобных отделах. Типичные роландические спайки могут сочетаться с медленными комплексами «острая-медленная волна», характерными для синдрома Леннокса-Гасто, или нерегулярной диффузной пик-волновой активностью частотой около 2,5 кол./с и амплитудным региональным преобладанием в лобных отделах; могут определяться фокальные спайки или медленные волны в центрально-височной области или центрально-височно-теменной области (рис. 3.2б).
В приступной ЭЭГ может отмечаться асинхронное появление разрядов высокоамплитудных нерегулярных диффузных комплексов «пик-волна» или «острая-медленная волна» частотой 1.5–4 кол./с длительностью 3–10 с, синхронно с пароксизмом атипичных абсансов .
Online-консультации врачей
| Консультация диагноста (лабораторная, радиологическая, клиническая диагностика) |
| Консультация неонатолога |
| Консультация психоневролога |
| Консультация психолога |
| Консультация стоматолога |
| Консультация эндокринолога |
| Консультация сосудистого хирурга |
| Консультация проктолога |
| Консультация нефролога |
| Консультация сексолога |
| Консультация эндоскописта |
| Консультация гомеопата |
| Консультация вертебролога |
| Консультация дерматолога |
| Консультация гастроэнтеролога |
Новости медицины
Футбольные фанаты находятся в смертельной опасности,
31.01.2020
«Умная перчатка» возвращает силу хвата жертвам травм и инсультов,
28.01.2020
Назван легкий способ укрепить здоровье,
20.01.2020
Топ-5 салонов массажа в Киеве по версии Покупон,
15.01.2020
Новости здравоохранения
Глава ВОЗ объявил пандемию COVID-19,
12.03.2020
Коронавирус атаковал уже более 100 стран, заразились почти 120 000 человек,
11.03.2020
Коронавирус атаковал 79 стран, число жертв приближается к 3200 человек,
04.03.2020
Новый коронавирус атаковал 48 стран мира, число жертв растет,
27.02.2020
Термины, используемые при расшифровке ЭЭГ
При диагностической оценке ЭЭГ учитывают частотный состав ЭЭГ, ее компоненты и характер организации (паттерн) биоэлектрической активности
Чтобы правильно описать и интерпретировать ЭЭГ, важно хорошо владеть специальной терминологией, принятой Международной федерацией клинической нейрофизиологии
Волна – одиночное колебание потенциала любой амплитуды и формы.
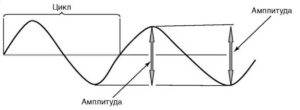 Схема определения амплитуды и периода отдельной волны
Схема определения амплитуды и периода отдельной волны
Амплитуда волны – величина колебания потенциала от пика до пика, измеряется в микровольтах и милливольтах.
Период (цикл) – длительность интервала между началом и концом одиночной волны или комплекса волн. Период отдельных волн ритма ЭЭГ обратно пропорционален частоте этого ритма.
Частота – число волн или комплексов волн в секунду.
Полоса частот – часть спектра синусоидальных колебаний электромагнитных излучений, лежащая в определенных пределах.
Диапазон частот – участок частотного спектра изменчивости потенциалов головного мозга, ограниченный определенными частотными рамками. Современная классификация частот выделяет следующие диапазоны: δ-диапазон – 0,5-4 колебаний/с, θ-диапазон – 4,5-7 колебаний/с, α-диапазон – 8-12 колебаний/с, ß1-диапазон – 16-20 колебаний/с, ß2-диапазон – 20-35 колебаний/с, γ-диапазон – выше 35 колебаний/с.
Компонент – любая отдельная волна или комплекс волн, различаемых на ЭЭГ.
Комплекс (волновой комплекс) – активность, состоящая из двух или нескольких волн характерной формы, отличных от основного фона, и имеющая тенденцию сохранять свою структуру при повторении.
Ритм ЭЭГ – спонтанная электрическая активность мозга, состоящая из волн, имеющих относительно постоянный период).
На ЭЭГ взрослого человека выделяют α- и ß-ритмы, а также сенсо-моторный, или σ-ритм – 13-15 колебаний/с.
Патологическими для взрослого бодрствующего человека являются δ- и θ-ритмы.
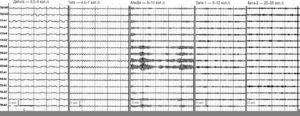 Примеры электроэнцефалографических ритмов различных частотных диапазонов
Примеры электроэнцефалографических ритмов различных частотных диапазонов
Индекс – относительный показатель выраженности какой-либо активности ЭЭГ. Индекс α (θ, δ и т.д.) – время (в %), в течение которого на каком-либо отрезке кривой выражена данная активность. Интегральный индекс, характеризующий структуру ЭЭГ в целом, отношение интенсивности быстрых (α + ß) и медленных (δ- и θ-) ритмов.
Визуальный анализ ЭЭГ включает описание главных, наиболее выраженных компонентов α-, ß-, θ- и δ-ритмов по степени выраженности, частоте, амплитуде (очень низкая – до 10 мкВ, низкая – до 20 мкВ, средняя – 40-50 мкВ, высокая до 70-80 мкВ, очень высокая – выше 80 мкВ) и по зональным различиям.
Кроме того, отмечают локальные патологические знаки, наличие пароксизмальной и эпилептической активности, описывают отдельные типы биоэлектрических потенциалов и их характер.
Footnotes
- Зенков Л.Р. Электроэнцефалография. В кн.: Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. 2-е издание. М.: Медицина. 1991, с. 7-146.
- Friedlander W. J. Equivocation in EEG Reporting: the clinicians responce. Clin, electroencephalogr., 1979, v. 10, p. 219—221.
- Maurer К. et а!., 1989; GiannitrapaniD. etal., 1991; IznakA.F. etal., 1992
- Nagata К., 1990
- Болдырева Г.И., 1994
- Зимкина A.M., Домонтович Е.Н., 1966
- Maurer К. etal., 1989
- MoultonR. etal., 1988
- Русинов B.C., Гриндель О.М., 1987
- Монахов К.К. и др., 1983; Стрелец В.Б., 1990
- Карлов В.А., 1990; Сараджишвили П.М., Геладзе Г.Ш., 1977; PenfieldW., JasperH.H., 1954
Классификация ЭЭГ по Cohn
Некоторые авторы предлагают классифицировать ЭЭГ по степени тяжести встречающихся в них аномалий. Так, Cohn (1949) различает четыре типа ЭЭГ: 1) нормальные и погранично измененные; 2) легко измененные; 3) умеренно измененные и 4) тяжело измененные.
- Погранично измененные ЭЭГ. О пограничных с нормой ЭЭГ говорят при небольших отклонениях от неизменной ЭЭГ. Это означает, что по степени выраженности альфа-активности обнаруживаются колебания, доходящие до нерегулярной активности. Амплитуда альфа-волн может быть очень большой, а амплитудные межполушарные различия могут достигать 30 %. Тета-волны нередко достигают вольтажа альфа-волн. Бета-активность может регистрироваться более отчетливо, чем в группе бета-ЭЭГ. Подобные изменения нередко наблюдаются при вегетативных и вазомоторных расстройствах, у психопатов, а иногда как электрографическое выражение тех остаточных явлений повреждения ЦНС, которые имелись в раннем детском возрасте. Появление центральных аркоподобных волн (ритмы), высокая альфа-активность и расщепление тета-частот на гармоники можно оценивать как показатель повышенной возбудимости. Подобные изменения на ЭЭГ часто встречаются при различных хронических заболеваниях, состояниях внутреннего напряжения, циркуляторных расстройствах и задержке развития.
- Легко измененные ЭЭГ. Альфа-активность нерегулярная или очень лабильная, т. е. частота ее колеблется больше, чем ± 1,5 колебания в секунду от средней величины. Амплитудные межполушарные различия превышают 30 %. Эффект закрывания глаз выражен плохо или отсутствует. Диффузная, или локальная тета-активность, выше, чем в норме. Может встречаться высокая бета-активность, маленькие острые волны, пароксизмальные группы тета-волн.
- Умеренно измененные ЭЭГ. Альфа ритм замедляется до 8–7/с или вообще отсутствует. Имеется отчетливая межполушарная асимметрия. Преобладает диффузная тета-активность. Встречаются средней группы дельта-волны и пики. Такие изменения являются выражением патологических нарушений функций головного мозга.
- Тяжело измененные ЭЭГ. Альфа-ритм отсутствует или имеются небольшие группы его с резко замедленной частотой. Регистрируются диффузные тета- и дельта-волны. Могут встречаться высокоамплитудные серии бета-волн. Полиморфная медленная активность может быть периодической или непрерывной, обусловливающей при значительных колебаниях в частоте и амплитуде наличие дизритмии. Часто встречаются пароксизмальные типы активности.
Footnotes
- Luders H., Noachtar S., eds. Atlas and Classification of Electroencephalography. Philadelphia: W.B. Saunders; 2000
- Гриндель О.М. Клиническая электроэнцефалография / О.М. Гриндель. М.: Медицина, 1973. 340 с
- Егорова И.С. Электроэнцефалография / И.С. Егорова. М.: Медицина, 1973. 296 с.
Аффективно-респираторный синдром: МКБ, классификация
- Легкая стадия. Длится около 15 секунд, ребёнок не способен нормально дышать. Опасности для мозга нет, но всё равно стоит обратиться к неврологу.
- «Бледная» стадия. Возникает из-за внешних факторов. Например, из-за боли, удара, укола или падения. При приступах, у ребёнка наблюдается бледность, он может упасть в обморок. Аффективные симптомы типа плача или крика могут не проявляться.
- «Синяя» стадия. Катализатором приступов является окружающая обстановка: стресс, давление, сильное возбуждение. Симптомами при этой стадии являются: кожа становится синей, апноэ длится около 20 секунд, в редких случаях проявляются судороги.
- Осложнённый Аффективно-респираторный синдром. Часто проявляется у грудничков. Данная стадия отличается от прошлых своей сложностью и длительностью приступов. Синдром проявляется не только из-за темперамента или характерных особенностей, но и из-за проблем с ЦНС.
Симптомы Детской эпилепсии с пароксизмальной активностью на ЭЭГ в затылочной области:
Возраст начала вариабелен (15 мес. — 17 лет). Пик манифестации симптомов 5-7 лет.
- Приступы и дебют имеют 2 различных варианта:
- 1. Ранний дебют (2-7 лет). Редкие ночные приступы, начинающиеся со рвоты, девиации глаз в сторону и нарушением сознания. Иногда — переход в гемиконвульсивный или генерализованный тонико-клонический приступ.
- 2. Поздний дебют (старше 7 лет). Преходящие нарушения зрения — 65%, амавроз — 52%, элементарные зрительные галлюцинации — 50%, сценоподобные галлюцинации — 14%. Сознание чаще сохранено, приступы, как правило, в дневное время. Гемиклонические судороги — 43%, ГКТП — 13%, автоматизмы — 13%, версивные движения — 25%. Послеприступное состояние в 33% случаев сопровождается головной, чаще мигренеподобной болью, в 17% — тошнотой и рвотой. Провоцирующие факторы: в 25% — резкая смена освещенности при переходе из темного помещения в светлое.
Психика обычно без особенностей, иногда — эмоциональные расстройства. В нейропсихологическом статусе — снижение зрительной памяти, проявления идеомоторной апраксии.
Неврология, как правило, без особенностей.
Образец бланка для интерпретации ЭЭГ
Компьютерное ЭЭГ-обследование
Дата обследования_
Фамилия, имя, отчество_возраст_диагноз_
Общая характеристика электрической активности
1. Организована. 2. Дезорганизована. 3. Гиперсинхронна. 4. Уплощена. 5. Учащена. 6. Замедлена.
-
α-Ритм
- Частота: 7-8, 9-11, 11-13 Гц, неустойчивая.
- Регулярность: регулярен, нерегулярен, в виде групп волн, отсутствует. По данным спектрального анализа ЭЭГ индекс α составляет: амплитуда: снижена, повышена, нормальна; зональные различия: сохранены, снижены; форма α-волны: синусоидальная, заостренная, аркообразная, слабо модулированная.
- Межполушарная асимметрия: нет, слабая, отчетливая.
- β-Активность: частота, амплитуда, локализация, индекс.
- θ-Активность: частота, амплитуда, локализация, индекс.
- δ-Активность: частота, амплитуда, локализация, индекс.
- Пароксизмальная активность: острые волны и пики, множественные пароксизмы, пик-волна, билатер. синхр. вспышки-α, θ, δ.
Функциональные пробы
- Реакция активации (проба с открыванием глаз): реакция отсутствует, слабая, выраженная, провокация пароксизмальной активности или иной патологической активности.
- Гипервентиляция:не изменяет, усиливает α-, θ-, δ-актив., нарастание дизритмии, синхронные пароксизмы θ или δ, генерализованные разряды, локальные пик-волны
- Ритмическая фотостимуляция: депрессия, РУР в узком, широком диапазоне низких, высоких частот, межпол. асим., провоцирование эпи-разрядов.
- Звуковые раздражения:реакция нормальна, усилена, ослаблена
На основании картирования спектров мощности ЭЭГ выявлено: локальные проявления: неотчетливые, асимметрия, преобладание, фокус, очаг;
- топография: правая, левая, асимметрия затылочная, теменная, центральная, лобная, височная;
- стволовые знаки: незначительные, умеренные, выраженные, срединные, передние отделы.
Патогенез фокальной эпилепсии
Причинами развития фокальной эпилепсии являются: пороки развития, которые затрагивают ограниченный участок головного мозга (артериовенозные мальформации головного мозга, фокальная корковая дисплазия, врождённые церебральные кисты и т. п.), черепно-мозговые травмы, инфекции (абсцесс головного мозга, энцефалит, нейросифилис, цистицеркоз), нарушения сосудистой системы (перенесенный геморрагический инсульт), метаболическая энцефалопатия, опухоли головного мозга. При ФЭ одними из этиологических факторов при сохранной морфологии нейронов и мозгового вещества в целом могут быть приобретенные и генетически обусловленные метаболические дефекты нейронов некоторой зоны коры больших полушарий.
Перинатальные поражения ЦНС являются ведущей причиной среди факторов возникновения фокальной эпилепсии. Такими поражениями являются: гипоксия плода, асфиксия новорожденного, внутричерепная родовая травма, внутриутробные инфекции. Появление фокального паталогического очага в детском возрасте может быть связано с нарушением созревания коры.
Патофизиологической основой ФЭ выступает эпилептогенный фокус, в котором выделяют несколько зон. Зона патологического повреждения соответствует участку морфологических изменений церебральной ткани, которую можно зафиксировать при помощи МРТ.
Первичная зона — это та часть мозговой коры, в которой генерируются эпи-разряды.
Симптоматогенная зона – это область коры, при возбуждении которой возникает эпилептический приступ. Ирритативная зона— это область, которая регистрируется на ЭЭГ в межприступный промежуток, и является источником эпилептического приступа.
Зона функционального дефицита — это участок, отвечающий за неврологические расстройства, которые сопутствуют эпиприступам.
Формы лечения и оказания первой помощи
Лечение направлено не на пароксизмальную активность, а на её причины и последующие проявления:
- При травме головы устраняется повреждающий фактор, восстанавливается кровообращение, определяются симптомы для дальнейшего лечения.
- Терапия при пароксизмах, связанных с давлением, направлена на лечение сердечно-сосудистой системы.
- Эпилептическая природа, особенно с проявлением большого судорожного припадка, предполагает, обращение в неврологическое или нейрохирургическое отделение. Свидетели припадка должны во избежание травм применить роторасширитель или использовать обёрнутую в бинт ложку, предотвратить асфиксию из-за запавшего языка или рвотных масс, вызвать скорую. Лечение больных с подобными эпилептическими проявлениями начинается в скорой, где применяют противоэпилептические препаратов (антиконвульсанты). Эти же средства эффективны для избавления от панических атак и обмороков.
- Вегетативные пароксизмы лечатся препаратами, воздействующими на ГАМКергические системы (Клоназепам, Альпрозолам). Многие отмечают эффективность Финлепсина и Кавинтона в терапии пароксизмальных состояний неэпилептического характера.
Синдром Леннокса-Гасто.
Синдром Леннокса-Гасто (СЛГ) – эпилептическая энцефалопатия детского возраста, характеризующаяся полиморфизмом приступов, специфическими изменениями ЭЭГ и резистентностью к терапии. Частота СЛГ составляет 3-5% среди всех эпилептических синдромов у детей и подростков; болеют чаще мальчики.
Заболевание дебютирует, преимущественно, в возрасте 2-8 лет (чаще 4-6 лет). Если СЛГ развивается при трансформации из синдрома Веста, то возможно 2 варианта:
Инфантильные спазмы трансформируются в тонические приступы при отсутствии латентного периода и плавно переходят в СЛГ.
Инфантильные спазмы исчезают; психомоторное развитие ребенка несколько улучшается; картина ЭЭГ постепенно нормализуется. Затем спустя некоторый латентный промежуток времени, который варьирует у разных больных, появляются приступы внезапных падений, атипичные абсансы и нарастает диффузная медленная пик-волновая активность на ЭЭГ.
Для СЛГ характерна триада приступов: пароксизмы падений (атонически- и миоклонически-астатические); тонические приступы и атипичные абсансы. Наиболее типичны приступы внезапных падений, обусловленные тоническими, миоклоническими или атоническими (негативный миоклонус) пароксизмами. Сознание может быть сохранено или выключается кратковременно. После падения не наблюдается судорог, и ребенок сразу же встает. Частые приступы падений приводят к тяжелой травматизации и инвалидизации больных.
Тонические приступы бывают аксиальными, проксимальными или тотальными; симметричными либо четко латерализованными. Приступы включают в себя внезапное сгибание шеи и туловища, подъем рук в состоянии полуфлексии или разгибания, разгибание ног, сокращение лицевой мускулатуры, вращательные движения глазных яблок, апноэ, гиперемию лица. Они могут возникать, как в дневное время, так и особенно часто, ночью.
Атипичные абсансы также характерны для СЛГ. Проявления их многообразны. Нарушение сознания бывает неполным. Может сохраняться некоторая степень двигательной и речевой активности. Наблюдается гипомимия, слюнотечение; миоклонии век, рта; атонические феномены (голова падает на грудь, рот приоткрыт). Атипичные абсансы обычно сопровождаются понижением мышечного тонуса, что вызывает как бы “обмякание” тела, начиная с мышц лица и шеи.
В неврологическом статусе отмечаются проявления пирамидной недостаточности, координаторные нарушения. Характерно снижение интеллекта, не достигающее, однако, тяжелой степени. Интеллектуальный дефицит констатируется с раннего возраста, предшествуя заболеванию (симптоматические формы) или развивается сразу после появления приступов (криптогенные формы).
При ЭЭГ-исследовании в большом проценте случаев выявляется нерегулярная диффузная, часто с амплитудной асимметрией, медленная пик-волновая активность с частотой 1,5-2,5 Гц в период бодрствования и быстрые ритмические разряды с частотой около 10 Гц – во время сна.
При нейровизуализации могут иметь место различные структурные нарушения в коре головного мозга, включая пороки развития: гипоплазия мозолистого тела, гемимегалэнцефалия, кортикальные дисплазии и пр.
В лечении СЛГ следует избегать препаратов, подавляющих когнитивные функции (барбитураты). Наиболее часто при СЛГ применяются вальпроаты, карбамазепин, бензодиазепины и ламиктал. Лечение начинается с производных вальпроевой кислоты, постепенно увеличивая их до максимально переносимой дозы (70-100 мг/кг/сут и выше). Карбамазепин эффективен при тонических приступах – 15-30 мг/кг/сут, но может учащать абсансы и миоклонические пароксизмы. Ряд больных реагирует на увеличение дозы карбамазепина парадоксальным учащением приступов. Бензодиазепины оказывают эффект при всех типах приступов, однако этот эффект временный. В группе бензодиазепинов применяются клоназепам, клобазам (фризиум) и нитразепам (радедорм). При атипичных абсансах может быть эффективен суксилеп (но не как монотерапия). Показана высокая эффективность комбинации вальпроатов с ламикталом (2-5 мг/кг/сут и выше). В США широко используется комбинация вальпроатов с фелбаматом (талокса).
Прогноз при СЛГ тяжелый. Стойкий контроль над приступами достигается лишь у 10-20% больных. Прогностически благоприятно преобладание миоклонических приступов и отсутствие грубых структурных изменений в мозге; негативные факторы – доминирование тонических приступов и грубый интеллектуальный дефицит.
Причины эпилепсии у детей
Мнение о том, что эпилепсия – исключительно наследственное заболевание, современными врачами не поддерживается. Некоторые ее формы не наследуются, некоторые являются следствием структурного поражения головного мозга (фокальные корковые дисплазии, врожденные аномалии развития головного мозга, туберозный склероз, ганглиомы и др.). Также нельзя однозначно утверждать, что к эпилепсии приводят какие-либо перенесенные человеком заболевания, однако они могут ускорить наступление болезни. Таковыми факторами являются:
- родовые травмы, возникновение кислородной недостаточности при рождении;
- черепно-мозговые травмы;
- кровоизлияния в мозг;
- новообразования в головном мозге (кисты, гематомы, опухоли);
- абсцесс мозга;
- инфекционные, паразитарные, вирусные заболевания;
- менингит, энцефалит.
Чем опасна эпилепсия у детей
- Во время приступа ребенок может получить серьезную травму, задохнуться рвотными массами, прикусить язык или щеку.
- Кроме этого, у детей бывают частые и тяжелые приступы с малым интервалом, когда они попросту не могут прийти в себя.
- Из-за постоянных приступов может сформироваться хроническая пневмония, развиться умственная отсталость.
Общие принципы лечения эпилепсии
В настоящее время выработаны общепринятые международные стандарты по лечению эпилепсии, которые необходимо соблюдать для повышения эффективности лечения и улучшения качества жизни пациентов.
Лечение эпилепсии может быть начато только после установления точного диагноза. Термины “предэпилепсия” и “профилактическое лечение эпилепсии” являются абсурдными. Существуют две категории пароксизмальных неврологических расстройств: эпилептические и неэпилептические (обмороки, снохождения, ночные страхи и пр.), и назначение АЭП оправдано только в случае эпилепсии. По мнению большинства неврологов, лечение эпилепсии следует начинать после повторного приступа. Единичный пароксизм может быть “случайным”, обусловленным лихорадкой, перегревом, интоксикацией, метаболическими расстройствами и не относиться к эпилепсии. В этом случае немедленное назначение АЭП не может быть оправданным, так как данные препараты являются потенциально высокотоксичными и не применяются с целью “профилактики”. Таким образом, АЭП могут применяться только в случае повторных непровоцируемых эпилептических приступов (т.е. при эпилепсии по определению).
В случае установления точного диагноза эпилепсии необходимо решить вопрос, следует или нет назначать АЭП? Разумеется, в подавляющем большинстве случаев, АЭП назначаются немедленно после диагностирования эпилепсии. Однако при некоторых доброкачественных эпилептических синдромах детского возраста (прежде всего, при роландической эпилепсии) и рефлекторных формах эпилепсии (эпилепсия чтения, первичная фотосенситивная эпилепсия и др.), допускается ведение пациентов без применения АЭП. Подобные случаи должны быть строго аргументированы.
Диагноз эпилепсии установлен и решено назначить АЭП. С 1980-х годов в клинической эпилептологии прочно утвердился принцип монотерапии: купирование эпилептических приступов должно осуществляться преимущественно одним препаратом. С появлением хроматографических методов определения уровня АЭП в крови стало очевидным, что многие антиконвульсанты имеют взаимный антагонизм, и одновременное их применение может значительно ослабить противосудорожный эффект каждого. Кроме того, применение монотерапии позволяет избежать возникновения тяжелых побочных эффектов и тератогенного воздействия, частота которых значительно возрастает при назначении нескольких препаратов одновременно. Таким образом, в настоящее время полностью доказана несостоятельность старой концепции о назначении большого количества АЭП одновременно в малых дозах. Политерапия оправдана только в случае резистентных форм эпилепсии и не более 3-х АЭП одновременно.
Подбор АЭП не должен быть эмпирическим. АЭП назначаются строго в соответствии с формой эпилепсии и характером приступов. Успех лечения эпилепсии во многом определяется точностью синдромологической диагностики (табл. 3).
АЭП назначаются, начиная с малой дозы, с постепенным увеличением до достижения терапевтической эффективности или появления первых признаков побочных эффектов. При этом определяющим является клиническая эффективность и переносимость препарата, а не содержание его в крови (табл. 4).
В случае неэффективности одного препарата, он должен быть постепенно заменен другим АЭП, эффективным при данной форме эпилепсии. При неэффективности одного АЭП нельзя сразу прибавлять к нему второй препарат, то есть переходить на политерапию не используя всех резервов монотерапии.
Принципы отмены АЭП.
АЭП могут быть отменены спустя 2,5-4 года полного отсутствия приступов. Клинический критерий (отсутствие приступов) является основным критерием отмены терапии. При большинстве идиопатических форм эпилепсии отмена препаратов может осуществляться через 2,5 (роландическая эпилепсия) — 3 года ремиссии. При тяжелых резистентных формах (синдром Леннокса-Гасто, симптоматическая парциальная эпилепсия), а также при юношеской миоклонической эпилепсии, данный период увеличивается до 3-4 лет. При продолжительности полной терапевтической ремиссии в течение 4-х лет, лечение должно быть отменено во всех случаях. Наличие патологических изменений на ЭЭГ или пубертатный период пациентов не являются факторами, задерживающими отмену АЭП при отсутствии приступов более 4-х лет.
Не существует единого мнения по вопросу о тактике отмены АЭП. Лечение может быть отменено постепенно в течение 1-6 мес или одномоментно по усмотрению врача.
часть-1 часть-2
Диагностика фокальной эпилепсии
Если парциальный пароксизм возник впервые, то пациенту необходимо детальное обследование, так как данный симптом может быть проявлением серьезной церебральной патологии. Во время консультации врач-невролог просит полностью описать длительность, характер, последовательность развития эпилептического приступа. Выявленные отклонения помогают установить расположение очага патологии.
Эпилептическая активность диагностируется с помощью ЭЭГ. Эпи-активность фокальной эпилепсии можно зафиксировать на ЭЭГ даже в межприступный период. Если ЭЭГ без приступа малоинформативна, то следует провести электроэнцефалоскопию с провокационными пробами и/или во время приступа. Субдуральная кортикография – это электроэнцефалоскопия с установлением электродов под твердой мозговой оболочкой. Помогает точно определить локализацию патологического очага.
Из инструментальных методов исследований наиболее эффективным для выяснения морфологических основ ФЭ является МРТ. Толщина срезов должна составлять около 1-2 мм, чтобы как можно точнее обнаружить мельчайшие дефекты вещества головного мозга. В случае симптоматической эпилепсии МРТ даёт возможность выявить первопричину: очаговые поражения, атрофии, дисплазии. В ряде случаев обнаружить подобные изменения не удается и тогда диагноз — идиопатическая или криптогенная ФЭ. В качестве дополнительного, но необязательного исследования может быть назначена ПЭТ головного мозга. ПЭТ зафиксирует эпилептогенный участок как зону повышенной метаболической активности. ОФЭКТ также применяется в качестве дополнительного метода диагностики, в ходе которого специалист способен отслеживать динамику перфузии церебрального вещества: в течение припадка будет наблюдаться картина гиперперфузии эпилептогенного очага, а в отрезок времени между пароксизмами — гипоперфузия.